
Si tiene cáncer de mama con receptores de estrógeno positivos (ER+), es probable que esté tomando el tamoxifeno. ¿Pero, sabía que la eficacia de este fármaco puede verse potenciada o comprometida en función de los alimentos y bebidas que toma?
¿Cómo funciona el Tamoxifeno?
El tamoxifeno es un tratamiento para el cáncer de mama ampliamente prescrito en mujeres menopáusicas. Actúa bloqueando los receptores de estrógenos en las células cancerosas de la mama, impidiendo que los estrógenos activen un futuro crecimiento de las células cancerígenas.
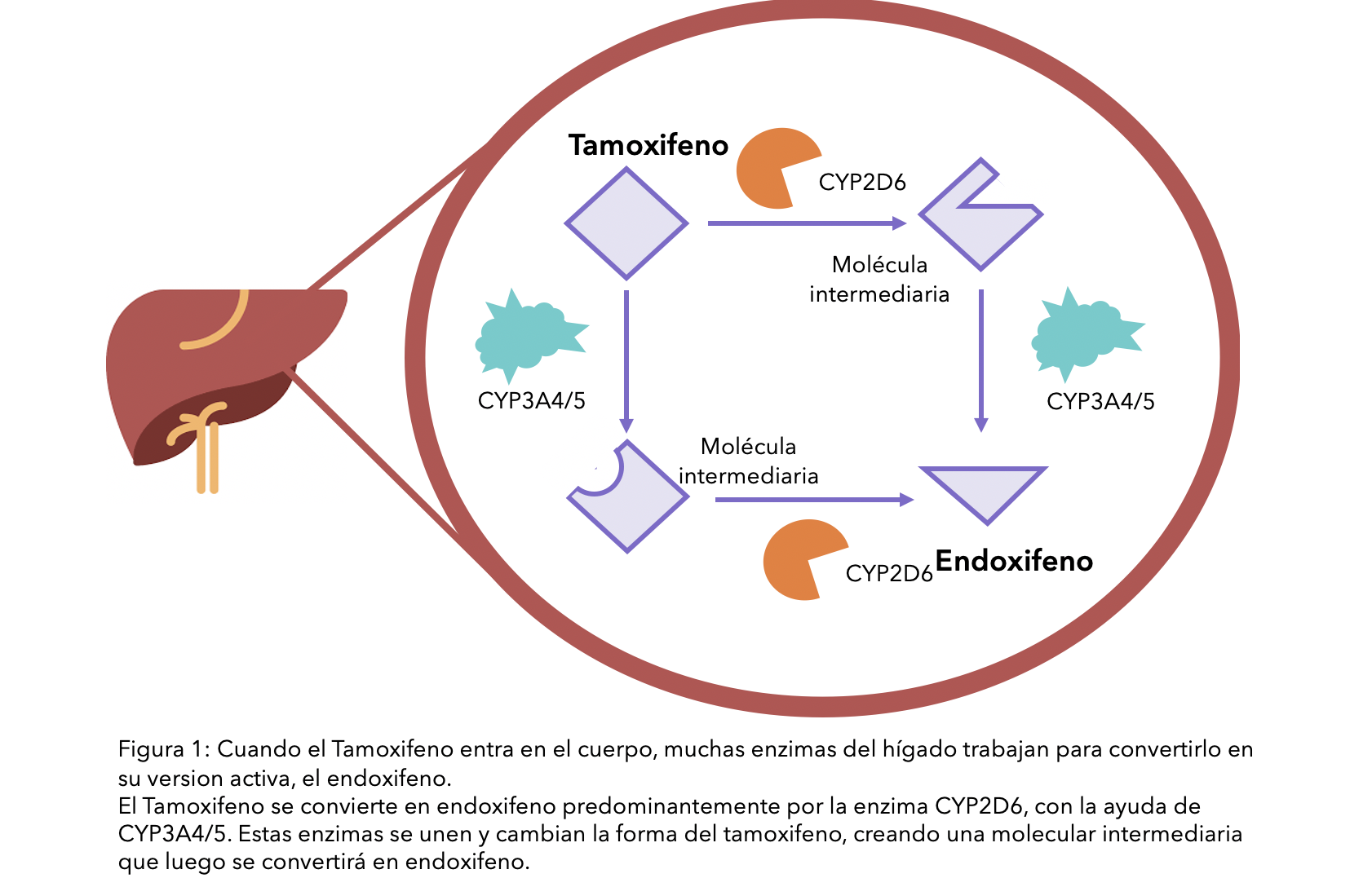
Para que el tamoxifeno funcione, su cuerpo necesita procesarlo transformándolo en su forma activa, endoxifeno. En cada paso del proceso, una enzima específica del riñón – una proteína que acelera el proceso dentro de las células – es usada para convertir una forma del fármaco en otra, hasta que el endoxifeno se ha formado (ver diagrama). La enzima principal en la conversión de tamoxifeno a endoxifeno se llama CYP2D6.
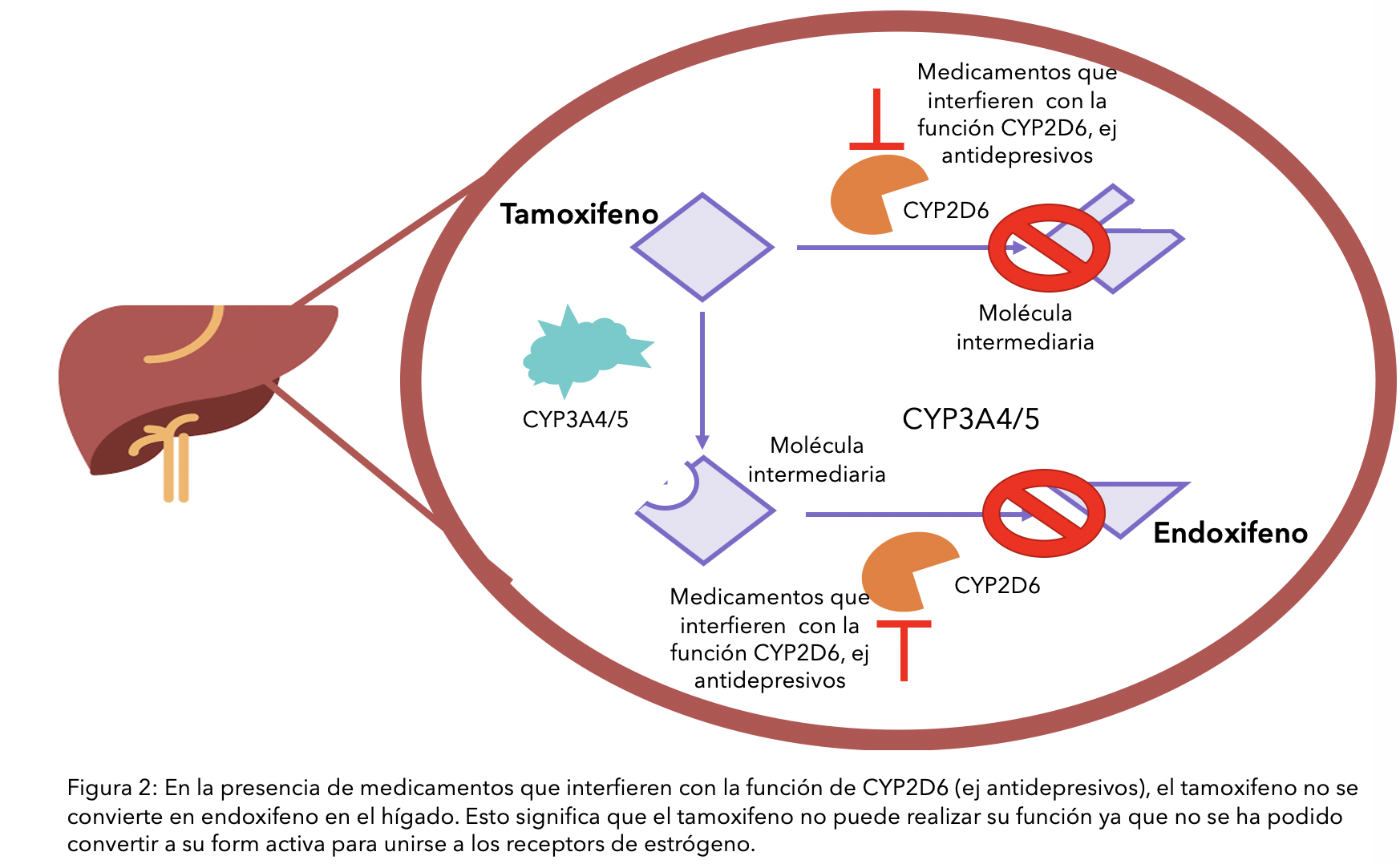
Para asegurar la conversión de tamoxifeno en su forma activa (endoxifeno), todas las enzimas hepáticas CYP2D6 deberían ser utilizadas. Sin embargo, esta enzima se necesita para descomponer otras sustancias. Por lo tanto, estas sustancias pueden «ocupar» la CYP2D6, dejando menos disponibilidad para convertir el tamoxifeno en endoxifeno. Esto daría lugar a que el tamoxifeno que tomó fuera etiquetado como ineficaz, ya que el organismo no podría procesarlo.1
Ciertos alimentos, bebidas y medicación pueden interferir en la conversión de tamoxifeno a endoxifeno por la enzima CYP2DG en diferentes extensiones. Si este proceso resulta alterado, la efectividad del tamoxifeno en su cuerpo puede también cambiar. Aunque esta enzima es muy importante en el proceso, la CYP3A4/5 también está involucrada (ver diagrama).
¿Sabía que puede monitorear los efectos secundarios, incluyendo los que causan más habitualmente el tamoxifeno, como por ejemplo sofocos, náusea y aumento de peso, con OWise? Poder visualizar cómo cambian sus síntomas a lo largo del tiempo, puede ayudarle a mejorar la comunicación con su equipo asistencial médico y asegurarle que recibe la mejor atención posible. Descargue la aplicación gratuita hoy mismo.
¿Hay algo que deba evitar comer o beber mientras esté tomando tamoxifeno?
Pomelo
El pomelo y su zumo son conocidos alteradores de numerosos medicamentos.2 Esto se debe principalmente a unas sustancias químicas llamadas «furanocumarinas» presentes en este. Se unen a la enzima CYP3A43, lo que significa que medicamentos como el tamoxifeno no pueden utilizar las enzimas ocupadas para convertirse en sus formas activas en el organismo. De esta manera reduce la eficacia del fármaco. En algunos casos, tan solo un pomelo o un vaso de zumo es suficiente para limitar la eficacia del fármaco como el tamoxifeno.2 Las naranjas de Sevilla (a menudo utilizadas en mermeladas) también producen furanocoumarinas3, 4, por lo que es posible que quiera limitar la ingesta de estas.
“Desaconsejaría encarecidamente que los pacientes en tratamiento con tamoxifeno tomen zumo de pomelo. Las investigaciones han demostrado que la enzima de los componentes del zumo de pomelo bloquea [CYP3A4], la cual es muy importante para la producción de endoxifeno reduciendo el efecto del tratamiento con tamoxifeno en su conjunto” – Prof. Ron Mathijssen, oncólogo médico del Instituto del Cáncer Erasmus MC y autor de numerosos estudios sobre el tamoxifeno.

Cúrcuma / Curcumina
Curcumina, la sustancia de color amarillo anaranjado brillante que contiene la cúrcuma, es una especia muy popular para ingerir, especialmente en quienes se someten a tratamientos contra el cáncer, debido a sus supuestos efectos anticancerígenos.5,6 Debido a su escasa absorción y a su rápido metabolismo en el organismo, la curcumina se suele ingerir en combinación con pimienta negra, ya que esta contiene piperina, que aumenta la eficacia de la curcumina en el organismo hasta 20 veces.7
Estudios previos han encontrado resultados contradictorios en cuanto si la curcumina aún entraría o deprimiría la efectividad del tamoxifeno.8,9,10 Sin embargo, un avance reciente encontró una relación general negativa entre el tamoxifeno y la curcumina.11 El estudio demostró que, con el consumo de curcumina, la cantidad efectiva de endoxifeno circulando en el organismo disminuía. Esta cantidad disminuía aún más con el consumo adicional de piperina.
Por lo tanto, si se está tomando tamoxifeno, puede ser mejor evitar la cúrcuma y la curcumina (particularmente en forma de suplemento concentrado), ya que puede disminuir la concentración de endoxifeno en el cuerpo interfiriendo con el impacto terapéutico del medicamento.
Cohosh negro
Es posible que haya oído hablar del cohosh negro como una alternativa a base de hierbas para contrarrestar los síntomas de la menopausia, como los sofocos. Aunque a algunas personas les puede resultar útil, no hay pruebas que respalden la eficacia del cohosh negro para reducir los sofocos.12 La investigación en laboratorios ha demostrado que el cohosh negro puede inhibir las dos enzimas principales que convierten el tamoxifeno en endoxifeno, lo que significa que puede reducir la función del tamoxifeno. Como esta investigación estudia las interacciones humanas de forma muy básica, se necesita más investigación clínica para demostrar realmente si el efecto en el organismo es significativo.
Será mejor evitar el cohosh negro si está tomando tamoxifeno y comentar con su médico las alternativas para contrarrestar los sofocos y otros síntomas de la menopausia. También puede consultar nuestras anteriores publicaciones de Instagram para obtener consejos sobre cómo controlarlos.
Mosto de San Juan
El mosto de San Juan es una hierba que suele utilizarse para tratar la depresión, ansiedad, sofocos y los problemas de sueño. Es especialmente popular entre los pacientes con cáncer, ya que suele considerarse un remedio natural seguro.13 14 Sin embargo, debido a algunas de sus propiedades, el mosto de San Juan puede interactuar con los tratamientos contra el cáncer y hacerlos menos eficaces. Se ha descubierto que el mosto de San Juan actúa como inductor de las enzimas CYP, y en particular de la enzima CYP3A4. En otras palabras, las sustancias que contiene el mosto de San Juan pueden inducir más enzimas CYP y aumentar su actividad.15, 16, 17, 18, 19
Tal y como se ha comentado previamente, las enzimas CYP son clave para descomponer tamoxifeno hacia su forma activa endoxifeno. Aumentando el número de estas enzimas puede llevar al tamoxifeno a ser expulsado del cuerpo demasiado rápido, antes de que pueda tener el efecto deseado bloqueando el crecimiento del cáncer.
Ensayos clínicos han demostrado que el mosto de San Juan interactúa con los fármacos de quimioterapia: irinotecan20, imatinib 21 y docetaxel 22, reduciendo la cantidad de medicamento circulando en sangre. Esto se debe al aumento de las enzimas CYP3A4 que causan que los quimiofármacos se eliminen demasiado rápido.23 Será mejor evitar los suplementos de mosto de San Juan si está tomando tamoxifeno o discutirlo con su médico. Cabe destacar, por ejemplo, que un ensayo clínico que investigaba el uso de mosto de San Juan para aliviar sofocos en pacientes con cáncer de mama se ha interrumpido debido a «la preocupación por la interacción entre el mosto de San Juan y el tamoxifeno».24
Ginseng
El ginseng es un suplemento que suele tomarse para aliviar ciertos efectos secundarios del tratamiento del cáncer, para reforzar el sistema inmunitario o para combatir la ansiedad.25 26
¿Sabía que hay más de un tipo de ginseng? Los dos más comunes son el ginseng americano (el nombre científico es Panax quinquefolius) y el ginseng asiático (el nombre científico es Panax ginseng). La mayoría de los estudios se centran en el ginseng asiático, y para este blog nos referimos principalmente al ginseng asiático.
El ginseng es un fuerte inhibidor de las enzimas CYP3A4 y CYP2D6. 19, 27, 28 Impide el funcionamiento de estas enzimas afectando a la capacidad de su cuerpo para procesar ciertos medicamentos que requieren su uso. El uso del ginseng junto con imatinib 29 (un fármaco de quimioterapia) provocó daños hepáticos que los investigadores relacionaron con las interacciones entre ambas sustancias. Debido a la conocida inhibición del ginseng de enzimas del CYP, es mejor evitar niveles elevados de este suplemento mientras se toma tamoxifeno.
¿Hay algo que deba comer o beber con moderación mientras tomo tamoxifeno?
Se recomienda tomar algunos alimentos con moderación mientras se toma tamoxifeno, ya que estudios han demostrado una relación entre estos y el metabolismo de este tratamiento. Sin embargo, sus efectos son pequeños, por lo que tomar estos alimentos de vez en cuando es correcto.
Camomila
El té de camomila es una bebida calmante que muchos disfrutan a diario y que tiene, aparentemente, innumerables beneficios. Sin embargo, los estudios han descubierto que, en experimentos de laboratorio, la camomila tiene la capacidad de interaccionar e inhibir las enzimas CYP2D6 y CYP3A4.30 Esto significa que la camomila podría interferir en la conversión del tamoxifeno en su forma activa de endoxifeno en el organismo. Pero actualmente no hay pruebas clínicas que lo demuestren. No cabe duda de que es necesario investigar más sobre esta relación, especialmente con estudios clínicos que analicen directamente si la camomila podría afectar a la eficacia del tamoxifeno en el organismo. Por ahora, lo mejor es que consulte a su médico o nutricionista para que le oriente sobre si debe empezar, o seguir ingiriendo, camomila mientras toma tamoxifeno.
Soja
Consumir soja sigue siendo una controversia entre aquellos diagnosticados con cáncer de mama. La preocupación suele provenir del hecho de que la soja contiene lo que se conoce como «fitoestrógenos», sustancias químicas que tienen estructuras similares a las de los estrógenos. Debido a la posibilidad de que estas sustancias químicas se unan a los receptores de estrógeno, se planteó la hipótesis de que podrían estimular el crecimiento de los cánceres de mama ER+.31, 32
Sin embargo, hay evidencia creciente que sugiere que el consumo de soja puede ser beneficioso para reducir el riesgo de cáncer de mama, la mortalidad y sus recurrencias31, 33, 34, aun tomando tamoxifeno.35 Actualmente, no hay respuestas definitivas sobre si la soja debería o no estar incluida en la dieta. Con más estudios clínicos en humanos, la compresión respecto a este tema podrá desarrollarse.
No hay evidencia clara que sugiera que debe parar de consumir soja después de ser diagnosticado de cáncer de pecho y tome tamoxifeno; podría ser beneficioso. Por lo tanto, si toma soja regularmente, o ha dejado de tomar porque pensaba que podría afectar a su tratamiento, no dude en seguir consumiéndola como parte de una dieta equilibrada.
Si no le gusta la soja o nunca la ha incluido en su dieta anteriormente, no hay necesidad de empezar ahora, pero si le gustaría incluirla, hable con su médico o nutricionista para que le aconsejen.
Semillas de lino
Al igual que la soja, las semillas de lino contienen fitoestrógenos, lo que supone un motivo de preocupación para las mujeres con cáncer de mama a lo largo de los años. Sin embargo, las pruebas actuales parecen indicar que las semillas de lino son seguras para las personas que toman tamoxifeno. No solo son seguras, sino
que, al igual que la soja, pueden ser beneficiosas para las personas con cáncer de mama que toman tamoxifeno. Los estudios sugieren que su consumo puede reducir el riesgo, el crecimiento y la recurrencia del cáncer de mama.36, 37, 38,39, 40
Mandarina
Las mandarinas y otras pieles de cítricos contienen una sustancia química llamada tangeretina, esta reduce la eficacia del tamoxifeno según se ha demostrado.41 Sin embargo, la pulpa actual de la fruta contiene mucha menos tangeretina que la cáscara, por lo que comer cantidades moderadas de mandarinas y otros cítricos de este tipo no debería suponer un problema. Sin embargo, deberá tener más cuidado con la cantidad de mermelada que consume, ya que estas suelen incluir la piel.
¿Hay algo que pueda comer o beber para aumentar la eficacia del tamoxifeno?
Té verde

El té verde es una bebida relajante y reconfortante que aparece una y otra vez en los foros de salud, con aparentes innumerables beneficios. Y no se queda ahí: los estudios han demostrado que el té verde interactúa con el tamoxifeno, potenciando su eficacia.42,43 El mecanismo que conduce a la beneficiosa interacción es a través de los flavonoides (sustancias con una estructura química llamada «fenólica») como el EGCG (galato de epigalocatequina) presente en el té verde.
Curiosamente, se ha descubierto que los flavonoides invierten los mecanismos por los que las células cancerosas podrían conseguir escapar del tamoxifeno y hacerse resistentes a él.44, 45, 46 Por lo tanto, la administración conjunta de té verde con tamoxifeno podría ser útil en los casos de cáncer de mama resistentes al tamoxifeno.47
¿Qué medicamentos debo tener en cuenta cuando tome tamoxifeno?
Antidepresivos
Los agentes antidepresivos a menudo se recetan a mujeres con cáncer de mama, no solo para contrarrestar la depresión, sino también para tratar la ansiedad y los sofocos.48 Sin embargo, muchos antidepresivos inhiben el CYP2D6 en diversos grados, lo que puede interferir en la conversión del tamoxifeno en endoxifeno49, 50,51 (ver diagrama). Los antidepresivos fluoxetina (Prozac® y Sarafem®) y paroxetina tienen la capacidad de reducir en gran medida la eficacia del tamoxifeno, ya que son fuertes inhibidores del CYP2D6, por lo que no deben prescribirse conjuntamente.
Sin embargo, existen antidepresivos alternativos más seguros para tomar durante el tratamiento con tamoxifeno que no inhiben el CYP2D6, como el escitalopram, la venlafaxina y la mirtazapina.52 El escitalopram (Cipralex® o Lexapro®) es el antidepresivo que se prescribe preferentemente a los pacientes que toman tamoxifeno, ya que interactúa menos en la conversión del tamoxifeno en endoxifeno, en comparación con otros antidepresivos como la fluoxetina.53 Si está tomando tamoxifeno y antidepresivos recetados, es probable que sea una de las tres opciones comentadas. Si su antidepresivo no es uno de los tres, puede valer la pena tener una conversación con su oncólogo en la próxima cita, para preguntar si el antidepresivo que está tomando es la mejor opción para usted y por qué.
Antipsicóticos
Se ha demostrado que diversos medicamentos antipsicóticos son inhibidores del CYP2D6.51, 54, 55, 56 En particular, de los antipsicóticos comunes. La tioridazina, la perfenazina y la pimozida son los inhibidores más potentes del CYP2D6, por tanto, no deben prescribirse junto con tamoxifeno. La clorpromazina, la flufenazina y el aloperidol también son inhibidores del CYP2D6, pero en menor medida. Si le han recetado alguno de los antipsicóticos mencionados y está tomando tamoxifeno, es posible que quiera hablar con su médico sobre si el antipsicótico que está tomando es la mejor opción para usted – hay varias alternativas más seguras para tomar junto con el tamoxifeno y que puede discutir con él.
Warfarina
Warfarina es un medicamento que se utiliza como anticoagulante. Se sabe que la warfarina y el tamoxifeno interactúan entre sí, y juntos provocan un mayor riesgo de hemorragia.57 Se desconoce el mecanismo exacto de esta interacción, pero se han detectado varios casos de complicaciones hemorrágicas en personas que toman tanto warfarina como tamoxifeno.58 Debido a esta evidencia, el BNF (British National Formulary) ha catalogado la warfarina y el tamoxifeno como una interacción grave.59 Si se prescriben estos medicamentos a la misma persona, se recomienda una monitorización estrecha y constante.
Aspectos importantes
Es importante tener en cuenta que la mayoría de los alimentos y bebidas se pueden consumir sin ningún tipo de problema, sobre todo con moderación, y algunos son incluso beneficiosos mientras se toma tamoxifeno. Sin embargo, recuerde que el exceso de algo bueno puede tener a veces efectos negativos. Tenga siempre cuidado con la toma de suplementos concentrados y hable con su médico o nutricionista especializado en cáncer sobre su dieta antes de introducir algo nuevo o hacer cambios drásticos.
 Dado que la mayoría de los alimentos son aceptables con moderación, puede ser útil anotar lo que ha comido diariamente. ¡Puede hacerlo directamente en la aplicación OWise!
Dado que la mayoría de los alimentos son aceptables con moderación, puede ser útil anotar lo que ha comido diariamente. ¡Puede hacerlo directamente en la aplicación OWise!
Podrá llevar un registro de la frecuencia con la que toma ciertos alimentos o bebidas para poder planificar cuándo reducir el consumo de algo que ha estado comiendo en exceso, o saber cuándo darse un capricho con algo que no suele tomar.
Referencias
1. Hansten, P.D., 2018. The underrated risks of tamoxifen drug interactions. European Journal of Drug Metabolism and Pharmacokinetics, 43(5), pp.495-508.
2. Bailey, D.G., Dresser, G. and Arnold, J.M.O., 2013. Grapefruit–medication interactions: Forbidden fruit or avoidable consequences?. Cmaj, 185(4), pp.309-316.
3. Guo, L.Q. and Yamazoe, Y., 2004. Inhibition of cytochrome P450 by furanocoumarins in grapefruit juice and herbal medicines. Acta Pharmacologica Sinica, 25(2), p.129.
4. Malhotra, S., Bailey, D.G., Paine, M.F. and Watkins, P.B., 2001. Seville orange juice‐felodipine interaction: comparison with dilute grapefruit juice and involvement of furocoumarins. Clinical Pharmacology & Therapeutics, 69(1), pp.14-23.
5. Sharma, R.A., Gescher, A.J. and Steward, W.P., 2005. Curcumin: the story so far. European journal of cancer, 41(13), pp.1955-1968.
6. Song, X., Zhang, M., Dai, E. and Luo, Y., 2019. Molecular targets of curcumin in breast cancer. Molecular medicine reports, 19(1), pp.23-29.
7. Shoba₁, G., Joy₁, D., Joseph₁, T., Rajendran₂, M.M.R. and Srinivas₂, P.S.S.R., 1998. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta medica, 64, pp.353-356.
8. Cho, Y.A., Lee, W. and Choi, J.S., 2012. Effects of curcumin on the pharmacokinetics of tamoxifen and its active metabolite, 4-hydroxytamoxifen, in rats: possible role of CYP3A4 and P-glycoprotein inhibition by curcumin. Die Pharmazie-An International Journal of Pharmaceutical Sciences, 67(2), pp.124-130.
9. Bahramsoltani, R., Rahimi, R. and Farzaei, M.H., 2017. Pharmacokinetic interactions of curcuminoids with conventional drugs: A review. Journal of ethnopharmacology, 209, pp.1-12.
10. Volak, L.P., Ghirmai, S. and Cashman, J.R., 2008. Curcuminoids inhibit multiple human cytochromes P450, UDP-glucuronosyltransferase, and sulfotransferase enzymes, whereas piperine is a relatively selective CYP3A4 inhibitor. Drug metabolism and disposition, 36(8), pp.1594-1605.
11. Hussaarts, K.G., Hurkmans, D.P., Oomen-de Hoop, E., van Harten, L.J., Berghuis, S., van Alphen, R.J., Spierings, L.E., van Rossum-Schornagel, Q.C., Vastbinder, M.B., van Schaik, R.H. and van Gelder, T., 2019. Impact of Curcumin (with or without Piperine) on the Pharmacokinetics of Tamoxifen. Cancers, 11(3), p.403.
12. Fritz, H., Seely, D., McGowan, J., Skidmore, B., Fernandes, R., Kennedy, D.A., Cooley, K., Wong, R., Sagar, S., Balneaves, L.G. and Fergusson, D., 2014. Black cohosh and breast cancer: a systematic review. Integrative Cancer Therapies, 13(1), pp.12-29.
13. Hutchinson, E., 2002. Not so innocent. Nat Rev Cancer 2, 720.
14. “St John’s Wort.” St John’s Wort Complementary and Alternative Therapy, Cancer Research UK, 11 Dec. 2018, www.cancerresearchuk.org/about-cancer/cancer-in-general/treatment/complementary-alternative-therapies/individual-therapies/st-johns-wort.
15. Kober M, Pohl K, Efferth T., 2008. Molecular mechanisms underlying St. John’s wort drug interactions. Curr Drug Metab. Dec;9(10):1027-37. PMID: 19075619.
16. Caraci, Filippo, et al., 2011. Metabolic Drug Interactions Between Antidepressants and Anticancer Drugs: Focus on Selective Serotonin Reuptake Inhibitors and Hypericum Extract. Current Drug Metabolism, vol. 12, no. 6, pp. 570–577.
17. Whitten, D.L.; Myers, S.P.; Hawrelak, J.A.; Wohlmuth, H., 2006. The effect of St John’s wort extracts on CYP3A: a systematic review of prospective clinical trials. Br. J. Clin. Pharmacol. 62(5), 512-526.
18. Moore LB, Goodwin B, Jones SA, et al., 2000. St. John’s wort induces hepatic drug metabolism through activation of the pregnane X receptor. Proc Natl Acad Sci USA. (13):7500-7502.
19. Graça, Campos, et al., 2018. Clinical Outcomes from Tamoxifen Drug-Herb Interactions. International Journal of Clinical Pharmacology & Pharmacotherapy, vol. 3, no. 2.
20. Mathijssen RH, Verweij J, de Bruijn P, Loos WJ, Sparreboom A., 2002. Effects of St. John’s wort on irinotecan metabolism. J Natl Cancer Inst. 21;94(16):1247-9.
21. Frye RF, Fitzgerald SM, Lagattuta TF, et al., 2004. Effect of St John’s wort on imatinib mesylate pharmacokinetics. Clin Pharmacol Ther 76 (4): 323-9.
22. Goey, Andrew K L et al., 2014. The effect of St John’s wort on the pharmacokinetics of docetaxel. Clinical pharmacokinetics vol. 53,1: 103-10.
23. de Jong, Floris A., et al., 2008. Lifestyle Habits as a Contributor to Anti-Cancer Treatment Failure. European Journal of Cancer, vol. 44, no. 3, pp. 374–382.
24. “St. John’s Wort in Relieving Hot Flashes in Postmenopausal Women With Non-Metastatic Breast Cancer – Full Text View.” Full Text View – ClinicalTrials.gov, clinicaltrials.gov/ct2/show/NCT00110136.
25. Chen, Shihong et al., 2014. Ginseng and anticancer drug combination to improve cancer chemotherapy: a critical review. Evidence-based complementary and alternative medicine : eCAM vol: 168940.
26. PDQ Integrative, Alternative, and Complementary Therapies Editorial Board. Foods, Dietary Supplements, and Cancer Therapy Interactions (PDQ®): Health Professional Version. 2020 Oct 14. In: PDQ Cancer Information Summaries [Internet]. Bethesda (MD): National Cancer Institute (US); 2002. Available from: https://www.ncbi.nlm.nih.gov/books/NBK563071/
27. Wanwimolruk, Sompon et al., 2014. Cytochrome P450 enzyme mediated herbal drug interactions (Part 2). EXCLI journal vol. 13 869-96.
28. Yang, Liang, et al., 2019. Panax Ginseng Inhibits Metabolism of Diester Alkaloids by Downregulating CYP3A4 Enzyme Activity via the Pregnane X Receptor. Evidence-Based Complementary and Alternative Medicine, vol. 2019 pp. 1–13., doi:10.1155/2019/3508658.
29. Bilgi, Naveen et al., 2010. Imatinib and Panax ginseng: a potential interaction resulting in liver toxicity. The Annals of pharmacotherapy vol. 44,5: 926-8. doi:10.1345/aph.1M715.
30. Ganzera, M., Schneider, P. and Stuppner, H., 2006. Inhibitory effects of the essential oil of chamomile (Matricaria recutita L.) and its major constituents on human cytochrome P450 enzymes. Life sciences, 78(8), pp.856-861.
31. Nechuta, S.J., Caan, B.J., Chen, W.Y., Lu, W., Chen, Z., Kwan, M.L., Flatt, S.W., Zheng, Y., Zheng, W., Pierce, J.P. and Shu, X.O., 2012. Soy food intake after diagnosis of breast cancer and survival: an in-depth analysis of combined evidence from cohort studies of US and Chinese women. The American journal of clinical nutrition, 96(1), pp.123-132.
32. Messina, M.J. and Loprinzi, C.L., 2001. Soy for breast cancer survivors: a critical review of the literature. The Journal of nutrition, 131(11), pp.3095S-3108S.
33. Nachvak, S.M., Moradi, S., Anjom-Shoae, J., Rahmani, J., Nasiri, M., Maleki, V. and Sadeghi, O., 2019. Soy, Soy Isoflavones, and Protein Intake in Relation to Mortality from All Causes, Cancers, and Cardiovascular Diseases: A Systematic Review and Dose–Response Meta-Analysis of Prospective Cohort Studies. Journal of the Academy of Nutrition and Dietetics, 119(9), pp.1483-1500.
34. Chi, F., Wu, R., Zeng, Y.C., Xing, R., Liu, Y. and Xu, Z.G., 2013. Post-diagnosis soy food intake and breast cancer survival: a meta-analysis of cohort studies. Asian Pac J Cancer Prev, 14(4), pp.2407-2412.
35. Shu, X.O., Zheng, Y., Cai, H., Gu, K., Chen, Z., Zheng, W. and Lu, W., 2009. Soy food intake and breast cancer survival. Jama, 302(22), pp.2437-2443.
36. Chen, J., Hui, E., Ip, T. and Thompson, L.U., 2004. Dietary flaxseed enhances the inhibitory effect of tamoxifen on the growth of estrogen-dependent human breast cancer (mcf-7) in nude mice. Clinical Cancer Research, 10(22), pp.7703-7711.
37. Flower, G., Fritz, H., Balneaves, L.G., Verma, S., Skidmore, B., Fernandes, R., Kennedy, D., Cooley, K., Wong, R., Sagar, S. and Fergusson, D., 2014. Flax and breast cancer: A systematic review. Integrative cancer therapies, 13(3), pp.181-192.
38. Lowcock, E.C., Cotterchio, M. and Boucher, B.A., 2013. Consumption of flaxseed, a rich source of lignans, is associated with reduced breast cancer risk. Cancer Causes & Control, 24(4), pp.813-816.
39. Chen, J., Power, K.A., Mann, J., Cheng, A. and Thompson, L.U., 2007. Flaxseed alone or in combination with tamoxifen inhibits MCF-7 breast tumor growth in ovariectomized athymic mice with high circulating levels of estrogen. Experimental biology and medicine, 232(8), pp.1071-1080.
40. Saggar, J.K., Chen, J., Corey, P. and Thompson, L.U., 2010. Dietary flaxseed lignan or oil combined with tamoxifen treatment affects MCF‐7 tumor growth through estrogen receptor‐and growth factor‐signaling pathways. Molecular nutrition & food research, 54(3), pp.415-425.
41. Bracke, M.E., Depypere, H.T., Boterberg, T., Van Marck, V.L., Vennekens, K.L.M., Vanluchene, E., Nuytinck, M., Serreyn, R. and Mareel, M.M., 1999. Influence of tangeretin on tamoxifen’s therapeutic benefit in mammary cancer. Journal of the National Cancer Institute, 91(4), pp.354-359.
42. Sartippour, M.R., Pietras, R., Marquez-Garban, D.C., Chen, H.W., Heber, D., Henning, S.M., Sartippour, G., Zhang, L., Lu, M., Weinberg, O. and Rao, J.Y., 2006. The combination of green tea and tamoxifen is effective against breast cancer. Carcinogenesis, 27(12), pp.2424-2433.
43. Shin, S.C. and Choi, J.S., 2009. Effects of epigallocatechin gallate on the oral bioavailability and pharmacokinetics of tamoxifen and its main metabolite, 4-hydroxytamoxifen, in rats. Anti-cancer drugs, 20(7), pp.584-588.
44. Farabegoli F, Papi A, Orlandi M, 2011.(-)-Epigallocatechin-3-gallate down-regulates EGFR, MMP-2, MMP-9 and EMMPRIN and inhibits the invasion of MCF-7 tamoxifen-resistant cells. Biosci Rep, 31:99-108.
45. Farabegoli F, Papi A, Bartolini G, Ostan R, Orlandi M, 2010.(-)-Epigallocatechin-3-gallate downregulates Pg-P and BCRP in a tamoxifen resistant MCF-7 cell line. Phytomedicine;17:356-362.
46. Farabegoli F, Barbi C, Lambertini E, Piva R, 2007. (-)-Epigallocatechin-3-gallate downregulates estrogen receptor alpha function in MCF-7 breast carcinoma cells. Cancer Detect Prev, 31:499-540.
47. Yiannakopoulou, E.C., 2014. Interaction of green tea catechins with breast cancer endocrine treatment: a systematic review. Pharmacology, 94(5-6), pp.245-248.
48. Irarrázaval, M.O. and Gaete, L.G., 2016. Antidepressants agents in breast cancer patients using tamoxifen: review of basic and clinical evidence. Revista medica de Chile, 144(10), pp.1326-1335.
49. Jin, Y., Desta, Z., Stearns, V., Ward, B., Ho, H., Lee, K.H., Skaar, T., Storniolo, A.M., Li, L., Araba, A. and Blanchard, R., 2005. CYP2D6 genotype, antidepressant use, and tamoxifen metabolism during adjuvant breast cancer treatment. Journal of the National Cancer Institute, 97(1), pp.30-39.
50. Kelly, C.M., Juurlink, D.N., Gomes, T., Duong-Hua, M., Pritchard, K.I., Austin, P.C. and Paszat, L.F., 2010. Selective serotonin reuptake inhibitors and breast cancer mortality in women receiving tamoxifen: a population based cohort study. Bmj, 340, p.c693.
51. Sideras, K., Ingle, J.N., Ames, M.M., Loprinzi, C.L., Mrazek, D.P., Black, J.L., Weinshilboum, R.M., Hawse, J.R., Spelsberg, T.C. and Goetz, M.P., 2010. Coprescription of tamoxifen and medications that inhibit CYP2D6. Journal of Clinical Oncology, 28(16), p.2768.
52. Desmarais, J.E. and Looper, K.J., 2009. Interactions between tamoxifen and antidepressants via cytochrome P450 2D6. The Journal of clinical psychiatry, 70(12), pp.1688-1697.
53. Binkhorst L., Bannink, M., de Bruijn, P., Ruit, J., Droogendijk, H., van Alphen, R.J., den Boer, D.T., Ho Lam, M., Jager, A., van Gelder, T. and Mathijssen, R.H.J., 2016. Augmentation of Endoxifen Exposure in Tamoxifen-Treated Women Following SSRI Switch. Clinical Pharmacokinetics, 55(9247), pp.249-255.
54. Otani, K. and Aoshima, T., 2000. Pharmacogenetics of classical and new antipsychotic drugs. Therapeutic drug monitoring, 22(1), pp.118-121.
55. Shin, J.G., Soukhova, N. and Flockhart, D.A., 1999. Effect of antipsychotic drugs on human liver cytochrome P-450 (CYP) isoforms in vitro: preferential inhibition of CYP2D6. Drug metabolism and disposition, 27(9), pp.1078-1084.
56. Desta, Z., Kerbusch, T., Soukhova, N., Richard, E., Ko, J.W. and Flockhart, D.A., 1998. Identification and characterization of human cytochrome P450 isoforms interacting with pimozide. Journal of Pharmacology and Experimental Therapeutics, 285(2), pp.428-437.
57. Mishra, D et al., 2007. Interaction between warfarin and tamoxifen: a case report. Kathmandu University medical journal (KUMJ) vol. 5,1: 105-7.
58. Givens, Carrie B et al., 2009. Safety of concomitant tamoxifen and warfarin. The Annals of pharmacotherapy vol. 43,11: 1867-71. doi:10.1345/aph.1M176.
59. NICE, 2021. Tamoxifen Interactions. British National Formulary Content (online) published by NICE. Joint Formulary Committee. London: https://bnf.nice.org.uk/interaction/tamoxifen-2.html.
