
Aproximadamente el 75% de los cánceres de mama dan positivos en el receptor de estrógeno (ER+) y/o receptor de progesterona (PR)1,2,3. Los casos de cáncer de mama con receptores hormonales (HR+) positivos aumentaron entre 1990 y 2015, concretamente en mujeres de 40 a 69 años. El aumento de la exposición a estrógenos puede ser una de las razones. Esta alta exposición puede estar relacionada con una menstruación temprana, un índice de masa corporal mayor o un mayor uso de terapias hormonales (como la terapia sustitutiva hormonal en mujeres posmenopáusicas). Tanto el tamoxifeno como los inhibidores de la aromatasa (IA) son terapias hormonales que se utilizan en el tratamiento del cáncer de mama ER+ con el fin de detener el crecimiento del tumor y su reaparición.
El estrógeno y la progesterona son hormonas que circulan por la sangre para indicar a otras partes del cuerpo cómo funcionar. En las mujeres, el estrógeno y la progesterona son las hormonas sexuales principales que regulan los ciclos menstruales y desempeñan un papel vital en el embarazo.
En el cáncer de mama, estas hormonas tienen una función muy diferente. Estimulan el crecimiento de las células cancerosas cuando entran en contacto con ellas. Este descubrimiento ha permitido la fabricación de toda una nueva categoría de tratamiento: la terapia hormonal. ¡Siga leyendo para saber qué son y cómo funcionan!
El estrógeno es la hormona femenina principal que estimula el crecimiento de las células del cáncer de mama. Las células cancerosas ER+ tienen receptores de estrógeno en su superficie, cuando estos son activados por el estradiol (un tipo de hormona estrogénica circulante), las células se multiplican (proliferan) y por tanto el cáncer crece4.
¿Dónde se produce el estrógeno?
En mujeres premenopáusicas, el estrógeno se produce principalmente en los ovarios. Sin embargo, en todas las personas, incluidos los hombres, también hay una pequeña cantidad de estrógenos que se produce en otros tejidos como: las células grasas, las mamas, los huesos, el hígado y el cerebro5. En este caso, la enzima aromatasa sirve para convertir otras hormonas (como la testosterona) en estradiol. Con la menopausia, ya no se produce estrógeno en los ovarios, pero la actividad de la aromatasa persiste, por lo que el estrógeno sigue presente.
¿Cómo funciona el Tamoxifeno?
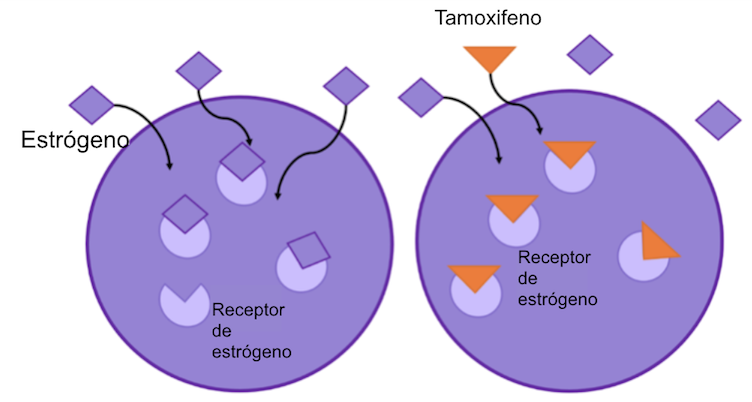
Figura 2: el tamoxifeno se uno a los receptores de estrógeno, previniendo que el estrógeno se una. Esto bloquea la capacidad del estrógeno de hacer crecer las células cancerígenas,
El tamoxifeno fue la primera terapia específica basada en hormonas que se utilizó en el tratamiento del cáncer de mama demostrando un éxito clínico significativo6. Este fármaco se utiliza en el tratamiento de mujeres premenopáusicas y posmenopáusicas, al igual que en los hombres, cuyas biopsias de cáncer de mama mostraron niveles elevados del receptor de estrógenos. El tamoxifeno actúa bloqueando los receptores de estrógenos de las células cancerosas. De este modo, el estradiol sigue presente en cantidades normales en el organismo, pero no puede activar el crecimiento de las células cancerosas (ver diagrama).
Sin embargo, algunos pacientes con ER+ no responden al tamoxifeno, o se vuelven resistentes. Aunque los mecanismos para explicar la resistencia al tamoxifeno siguen sin ser claros, una de las hipótesis es que cuando las células están «hartas» de este fármaco, responden elevando la expresión del gen «AKT». Es un gen de supervivencia que ayuda a estimular el crecimiento y la proliferación celular en situaciones normales. En cáncer de mama, el gen AKT puede volverse hiperactivo y conferir resistencia, permitiendo que las células cancerosas sigan utilizando el receptor de estrógeno aun en presencia de tamoxifeno7. Otra hipótesis por la que algunos pacientes no podrían beneficiarse de tamoxifeno es debido a una enzima llamada CYP2D6. Esta convierte el tamoxifeno en su forma activa, pero alrededor del 10% de las personas tienen la enzima CYP2D6 que no funciona bien8. Tener la CYP2D6 anormal podría impedir que el tamoxifeno bloquee los receptores de estrógeno y el crecimiento del cáncer.
¿Cómo funcionan los inhibidores de aromatasa?
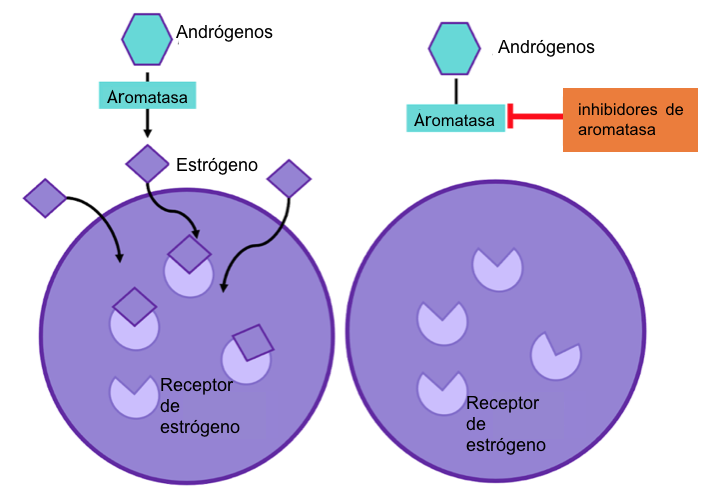
Figura 2: los inhibidores de aromatasa previenen que la enzima aromatasa funcione. Este proceso para la producción de estrógeno en el cuerpo y por lo tanto no hay estrógeno disponible para promover el crecimiento celular del cáncer.
Por otro lado, los inhibidores de la aromatasa (IA) se utilizan para tratar a mujeres posmenopáusicas y a hombres con cáncer de mama ER+. Los IA actúan impidiendo que la enzima aromatasa haga su trabajo de convertir otras hormonas en estradiol, por lo que detiene la producción de estrógenos (ver diagrama). Estos inhibidores son mucho más eficaces que el tamoxifeno para mujeres posmenopáusicas9,10. El motivo por el que los IA no se utilizan en pacientes premenopáusicas con cáncer de mama es porque no bloquean la producción de estradiol en los ovarios. Sin embargo, una mujer premenopáusica con función ovárica suprimida por fármacos como la goserelina11 puede ser tratada con el inhibidor de la aromatasa exemestano. El letrozol, el anastrozol y el exemestano son IA de tercera generación, y disminuyen los estrógenos circulantes hasta niveles indetectables12, reduciendo así la proliferación y el crecimiento del tumor13. Sin embargo, la tasa de respuesta varía entre 35% y 70% en el cáncer de mama primario y podría ser menor en cáncer avanzado14.
Controla los efectos secundarios de la terapia hormonal con OWise
 Las terapias hormonales pueden provocar múltiples efectos secundarios como el dolor articular. Algunos de los más comunes son: dolor de huesos y articulaciones, sofocos, náuseas, fatiga, cambios de humor, dolores de cabeza, estreñimiento, sequedad de la piel y pérdida de lívido. Con OWise, puede hacer un seguimiento de estos a lo largo del tiempo, compartir los datos de su bienestar consigo misma, con sus médicos y con sus seres querido
Las terapias hormonales pueden provocar múltiples efectos secundarios como el dolor articular. Algunos de los más comunes son: dolor de huesos y articulaciones, sofocos, náuseas, fatiga, cambios de humor, dolores de cabeza, estreñimiento, sequedad de la piel y pérdida de lívido. Con OWise, puede hacer un seguimiento de estos a lo largo del tiempo, compartir los datos de su bienestar consigo misma, con sus médicos y con sus seres querido
Pruebe a monitorear sus efectos secundarios y déjenos saber si este artículo le ha ayudado. ¿Tiene algún comentario o sugerencia? Contáctanos
Referencias
[1] Nadji M, Gomez-Fernandez C, Ganjei-Azar P, Morales AR. Immunohistochemistry of estrogen and progesterone receptors reconsidered: experience with 5,993 breast cancers. Am J Clin Pathol. 2005; 123:21–27.
[2] Lange CA, Yee D. Progesterone and breast cancer. Womens Health (Lond) 2008; 4:151–162.
[3] Moelans CB, de Ligt J, van der Groep P, Prins P, Besselink N, Hoogstraat M, ter Hoeve N, Lacle M, Kornegoor R, van der Pol C, de Leng W, Barbe E, van der Vegt B, Martens J, Bult P, Smits VT, Koudijs M, Nijman I, Voest E, Selenica P, Weigelt B, Reis-Filho J, van der Wall E, Cuppen E, van Diest PJ. The molecular genetic make-up of male breast cancer. Endocr Relat Cancer. 2019
[4] Johnston SRD and Dowsett M. Aromatase Inhibitors for breast cancer: Lessons from the laboratory. Nature Reviews, 2003; 3: 821-831
[5] Bulun SE, Lin Z, Imir G, Amin S, Demura M, Yilmaz B, Martin R, Utsunomiya H, Thung S, Gurates B, et al. Regulation of aromatase expression in estrogen-responsive breast and uterine disease: from bench to treatment. Pharmacological Reviews. 2005; 57:359–383
[6] Jordan VC, Brodie AM. Development and evolution of therapies targeted to the estrogen receptor for the treatment and prevention of breast cancer. Steroids. 2007; 72:7–25.
[7] Bostner J, Karlsson E, Pandiyan MJ, Skoog L, Fornancder T, Nordenskjold B, Stal O. Activation of Akt, mTOR, and the estrogen receptor as a signature to predict tamoxifen treatment benefit. Breast Cancer Res Treat. 2013;137(2):397-406.
[8] Goetz MP, Kamal A, Ames MM. Tamoxifen pharmacogenomics: the role of CYP2D6 as a predictor of drug response. Clin Pharmacol Ther. 2008;83(1):160-6.
[9] Geisler J, King N, Dowsett M, Ottestad L, Lundgren S, Walton P, Kormeset PO, Lonning PE. Influence of anastrozole (Arimidex), a selective, non-steroidal aromatase inhibitor, on in vivo aromatisation and plasma oestrogen levels in postmenopausal women with breast cancer. Br J Cancer. 1996; 74:1286–1291.
[10] Geisler J, King N, Anker G, Ornati G, Salle ED, Lonning PE, Dowsett M. In-vivo inhibition of aromatization by exemestane, a novel irreversible aromatase inhibitor, in post-menopausal breast cancer patients. Clinical Cancer Research. 1998; 4: 2089-2093.
[11] Francis PA, Regan MM, Fleming GF, Láng I, Ciruelos E, Bellet M, Bonnefoi HR, Climent MA, Da Prada GA, Burstein HJ, Martino S, Davidson NE, Geyer CE Jr, Walley BA, Coleman R, Kerbrat P, Buchholz S, Ingle JN, Winer EP, Rabaglio-Poretti M, Maibach R, Ruepp B, Giobbie-Hurder A, Price KN, Colleoni M, Viale G, Coates AS, Goldhirsch A, Gelber RD; SOFT Investigators; International Breast Cancer Study Group. Adjuvant ovarian suppression in premenopausal breast cancer. N Engl J Med. 2015 Jan 29;372(5):436-46.
[12] Geisler J, Haynes B, Anker G, Dowsett M, Lønning PE. Influence of letrozole and anastrozole on total body aromatization and plasma estrogen levels in postmenopausal breast cancer patients evaluated in a randomized, cross-over study. J Clin Oncol. 2002, 20: 751-757.
[13] Miller WR, Jackson J. The therapeutic potential of aromatase inhibitors. Expert Opin Investig Drugs. 2003, 12: 1-12. 10.1517/13543784.12.1.1.
[14] Smith IE, Dowsett M, Ebbs SR, Dixon JM, Skene A, Blohmer JU, Ashley SE, Francis S, Boeddinghaus I, Walsh G, IMPACT Trialists Group. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol. 2005, 23: 5108-5116.
