
Para entender exactamente lo que es la resistencia a la terapia hormonal, en primer lugar, debemos hablar de cómo funciona la terapia hormonal, para después entender mejor por qué se produce la resistencia y ver qué ocurrirá si usted se vuelve resistente a la terapia hormonal.
Si está leyendo esto, lo más probable es que tenga un cáncer de mama con receptores hormonales positivos, también denominados RH+, receptores de estrógenos o progesterona positivos (RE+ / RP+). Esto significa que las células del cáncer de mama necesitan estas hormonas para crecer. En concreto, responden a la presencia de estrógenos (RE) y progesterona (RP) en la sangre, las principales hormonas sexuales femeninas. Como se muestra en el diagrama, cuando el estrógeno entra en la célula cancerígenas, se une a los receptores (piense que el estrógeno es la llave y el receptor la cerradura), activándolos para que se unan al ADN y estimulen su crecimiento.
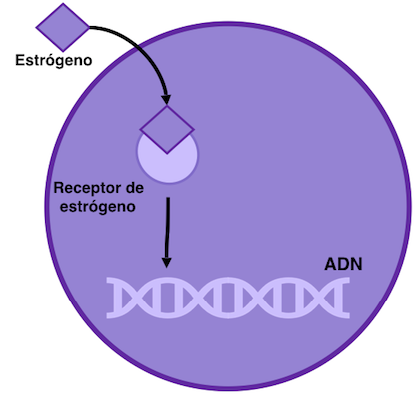
Figura 1: El cáncer de mama con receptor de estrógenos positivos depende del estrógeno para su crecimiento celular. El estrógeno se une al receptor de estrógeno que a continuación se une con otro receptor de estrógeno, formando un dímero (estructura de dos unidades). Entonces interactúan con el DNA, promoviendo el crecimiento celular.
En los años sesenta se descubrió por primera vez el cáncer de mama RH+, lo que condujo al desarrollo de la terapia hormonal. Esto significaba que podíamos utilizar la necesidad hormonal de los cánceres como tratamiento. Al interrumpir el acceso de los tumores a las hormonas, las células cancerosas ya no pueden crecer, lo que provoca la muerte de las células y detiene el cáncer en seco.
¿Sabías que? La primera terapia hormonal que se descubrió fue el tamoxifeno, y en realidad fue por error. En los años 60, un equipo de científicos estaba estudiando la posibilidad de fabricar un anticonceptivo oral que suprimiera los estrógenos. Sin embargo, durante las pruebas, descubrieron que el tamoxifeno estimulaba, en lugar de suprimir, la ovulación en las mujeres y que, en cambio, podía utilizarse como tratamiento para el cáncer de mama3.
Introducción a la resistencia a la terapia hormonal
¿Qué es?
Si tiene un cáncer de mama primario o secundario RH+, puede documentar cualquier cambio en sus síntomas y compartirlo con su médico. Esto puede servir tanto para determinar si el tratamiento es adecuado para usted como para indicar que el tratamiento no está funcionando. Lo más probable es que los cambios en los síntomas no signifiquen una resistencia, pero compartir sus síntomas o cualquier preocupación con su médico puede ayudarle a estar segura de que cualquier signo de resistencia a la terapia hormonal se notará desde el principio.
Con OWise, puede hacer un seguimiento de más de 30 efectos secundarios y síntomas y visualizar cualquier cambio en un gráfico fácil de ver. Si nota que algo no va bien, puede enviar estas tendencias directamente a su equipo médico. Esto puede ayudarles a entender su experiencia o cualquier cambio y decidir los pasos a seguir. Puede descargarse hoy mismo OWise, la aplicación ganadora de varios premios y validada científicamente.
¿Qué causa la resistencia a la terapia hormonal?
Una de las principales cuestiones relacionadas con la resistencia a la terapia hormonal es la amplia naturaleza de su aparición. No hay una sola vía que conduzca a la resistencia, sino que hay múltiples factores que, en las condiciones adecuadas, pueden combinarse. En este blog, examinaremos sólo una de las vías de resistencia a la terapia hormonal. ¡Esto es sólo uno de los factores de la resistencia hormonal, si usted está interesado en aprender acerca de otras vías, no dude en enviarnos un mensaje!
Receptor de estrógenos
Como se ha explicado anteriormente, el estrógeno se une a un receptor en la célula, llamado receptor de estrógeno (RE). El RE es una proteína que se produce parcialmente mediante el gen ESR1. Un gen es un trozo de material genético (ADN) que proporciona instrucciones a la célula para crear una proteína. El ESR1 es susceptible de sufrir cambios, denominados mutaciones, que pueden dar lugar a cambios en la función y la forma del receptor y a su eventual resistencia al tratamiento. Las mutaciones en el gen ESR1 parecen acumularse durante una mayor exposición a la terapia hormonal. Esta podría ser una de las razones por las que las mutaciones se observan con menos frecuencia en el cáncer de mama primario que en el secundario5.
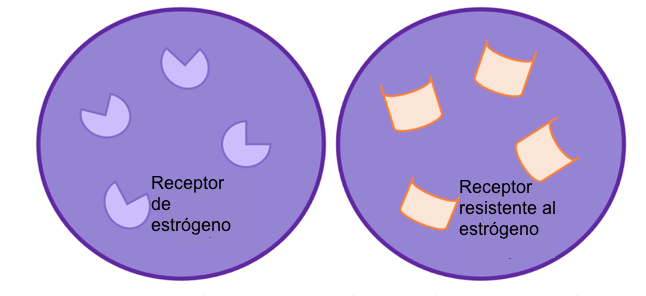
Figura 2: resistencia a la terapia hormonal. Cambios en el receptor quiere decir que la terapia hormonal, como los inhibidores de aromatasa ya no son efectivos y por tanto paran el crecimiento celular.
Un estudio que recopiló la investigación de muchos equipos diferentes descubrió que en el 24% de los casos de cáncer de mama había una mutación en el gen ESR15. En aproximadamente la mitad de estos casos, no hay una sola mutación, sino varias que actúan conjuntamente para resistir el tratamiento6,7.
Pero ¿cómo puede una mutación genética causar resistencia?
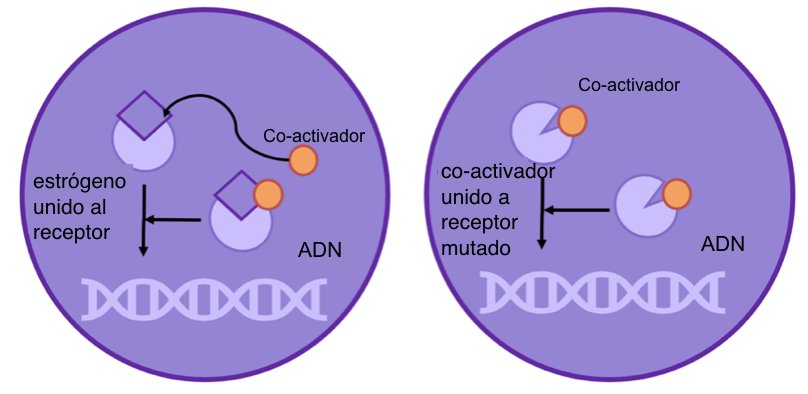
Figura 3: normalmente, tanto el estrógeno como el co-activador necesitan unirse al receptor antes que interaccione con el DNA. Sin embargo, si el receptor está mutado (cambiado), sólo es necesario que el co-activador se una para activar el receptor de estrógeno.
Tenga en cuenta que la resistencia a los fármacos es el resultado de la naturaleza del cáncer y no está controlada por las elecciones individuales. Con más investigación, se entenderá mejor la resistencia a los fármacos y se desarrollarán tratamientos más eficaces.
¿Son las mutaciones del receptor de estrógeno (RE) las responsables de la resistencia a todos los fármacos de terapia hormonal?
La respuesta es sencilla: no. Estas mutaciones son la causa de la resistencia en algunos casos para los tres fármacos clave de la terapia hormonal, los inhibidores de la aromatasa, incluidos el letrozol (Famara®), el anastrozol (Arimidex®) y el exemestano (Aromasin®), el tamoxifeno y el fulvestrant (Faslodex®). Sin embargo, otros mecanismos de resistencia a los fármacos que no incluyen el RE parecen estar en juego para cada tratamiento hormonal.
Todavía hay muchas cosas que desconocemos, y es necesario seguir investigando para comprender todos los mecanismos de resistencia a los fármacos. Sin embargo, según un estudio reciente que recopiló la investigación de múltiples equipos, los inhibidores de la aromatasa (IA) son los más susceptibles a esta forma de resistencia al RE5.Esto se debe a que el objetivo principal de los inhibidores de la aromatasa es eliminar cualquier estrógeno disponible para las células del cáncer de mama (consulte nuestro blog anterior en el que se explica cómo funcionan los IA). Si el receptor ya no necesita estrógenos para funcionar, este enfoque es ineficaz. Además, las mutaciones del RE parecen ocurrir predominantemente cuando no hay estrógeno circulante5.Por lo tanto, la acción de los IA (al eliminar el estrógeno circulante) podría conducir por sí misma a una eventual resistencia.
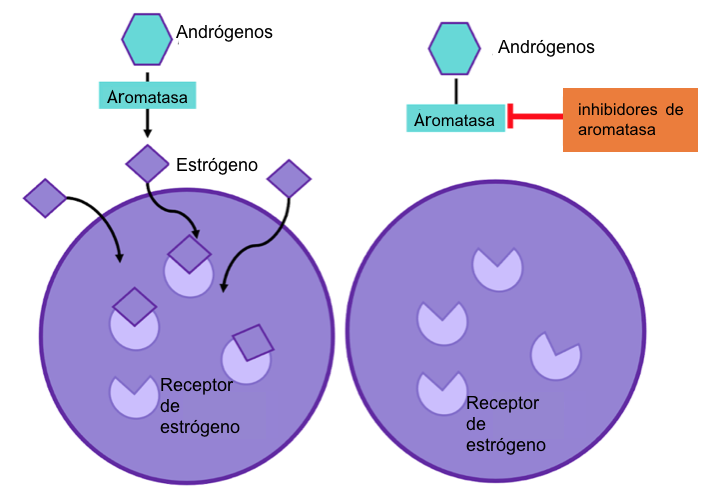
Figura 4: los inhibidores de aromatasa previenen que la enzima aromatasa funcione. Este proceso para la producción de estrógeno en el cuerpo y por lo tanto no hay estrógeno disponible para promover el crecimiento celular del cáncer.
El tamoxifeno y el fulvestrant tienen una historia completamente distinta. A diferencia de los IA, estos fármacos hormonales no interactúan con el estrógeno, sino con el RE directamente (consulte nuestro blog anterior en el que se explica cómo funciona el tamoxifeno). La capacidad del RE de funcionar sin estrógenos no altera necesariamente la función de estos fármacos. Sin embargo, si la mutación provoca un cambio en la forma del receptor, es posible que estos fármacos ya no puedan unirse al receptor y detengan su función. Esto se debe a que han sido diseñados para ser la llave de tamaño perfecto para la cerradura del RE (véase la figura 1). Si se produce una pequeña alteración en la estructura, la llave ya no puede encajar en la cerradura, y mucho menos abrirla.
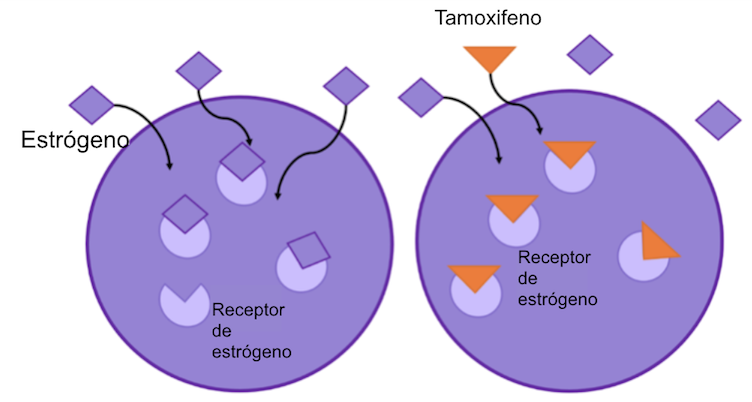
Figura 5: el tamoxifeno se une al receptor de estrógeno, previniendo la unión del estrógeno a este. Esta unión bloquea la posibilidad de que el estrógeno promueva el crecimiento celular.
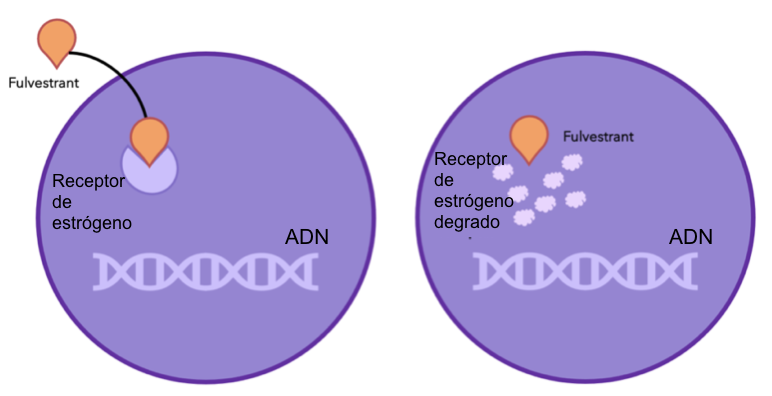
Figura 6: fulvestrant se une y degrada los receptores de estrógeno. Esto quiere decir que los receptores dejan de unirse al estrógeno, parando el crecimiento celular que depende del estrógeno.
¿Sabía que puede añadir todos tus tratamientos en OWise, creando un plan de tratamiento interactivo y fácil de ver?
¿Qué ocurre si tiene resistencia a la terapia hormonal?
Un equipo del Instituto de Investigación del Cáncer ha creado un análisis de sangre que puede detectar las mutaciones del ESR1 en la sangre. Esto permitirá una detección más rápida de posibles resistencias y ayudará a los pacientes a recibir más rápidamente los tratamientos más eficaces 10
Inhibidores de la CDK4/6
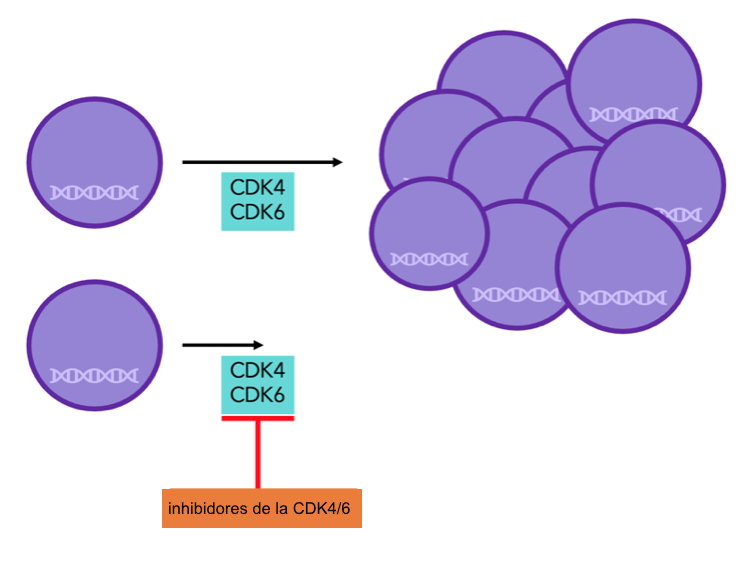
Figura 7: las proteínas CDK4/6 son necesarias para la división celular. Con los inhibidores de CDK4/6 no pueden funcionar adecuadamente, y por lo tanto, la división celular decrece.
Las investigaciones han demostrado que el uso de inhibidores de CDK4/6 puede disminuir el riesgo de mortalidad en un 21% cuando las pacientes son resistentes a las hormonas, y en un 27% cuando son sensibles a las hormonas12. Si tiene un cáncer de mama secundario, es probable que se le ofrezcan inhibidores de CDK4/6 como abemaciclib (Verzenio®), palbociclib (Ibrance®) o ribociclib (Kisqali®), en combinación con un inhibidor de la aromatasa o fulvestrant13. Si ya ha sido tratada, las opciones de segunda línea incluyen fulvestrant con alpelisib (Piqray®), y everolimus con terapia hormonal como un inhibidor de la aromatasa, tamoxifeno o fulvestrant.
¿Cuál es la diferencia entre los inhibidores de CDK4/6 disponibles?
Abemaciclib se toma dos veces al día, de forma continua. Palbociclib y ribociclib se toman en ciclos. Primero durante 21 días diarios, seguidos de 7 días sin tratamiento, antes de un ciclo de 28 días.
Los efectos secundarios también difieren entre cada uno. El abemaciclib se asocia a una mayor incidencia de diarrea, el palbociclib a una mayor incidencia de neutropenia, al igual que el ribociclib. La elección entre los tres se decidirá entre usted y su médico14.
Everolimus
Everolimus (Afinitor®) es una terapia dirigida que bloquea la proteína mTOR, que, al igual que la CDK4/6, es responsable del crecimiento y la división celular. La combinación de everolimus con el inhibidor de la aromatasa exemestano se recomienda si otros tratamientos, como la terapia hormonal, son ineficaces, debido a su éxito en el aumento de la supervivencia libre de progresión.
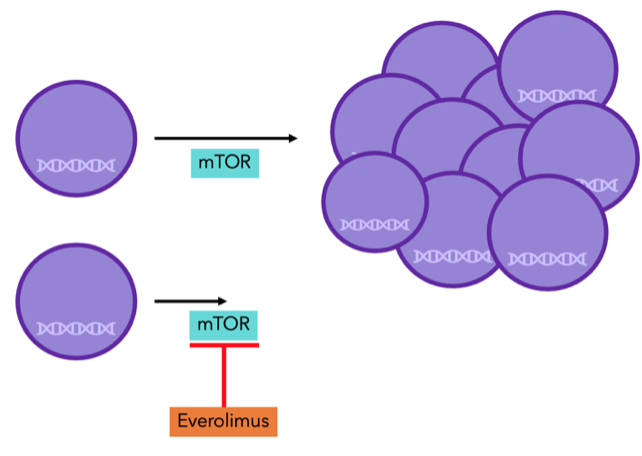
Figura 8: las proteínas mTOR son necesarias para la división celular. Con everolimus, no funciona adecuadamente, y por lo tanto la división celular decrece.
Al igual que con los inhibidores de CDK4/6, no existen biomarcadores que predigan la respuesta al everolimus, por lo que no se puede determinar antes del tratamiento si será eficaz para su cáncer de mama específico15. Debido a sus efectos secundarios más graves, como la hiperglucemia/diabetes, las úlceras bucales y la fatiga, los inhibidores de CDK4/6 junto con el fulvestrant son el tratamiento preferido16
Si experimenta efectos secundarios adversos al ser tratada con estos fármacos que alargan la vida, asegúrese de controlarlos con OWise. Al compartirlos con su médico, éste podrá ofrecerle tratamientos adicionales que detengan estos síntomas.
Perfiles genómicos avanzados
Si no está respondiendo a su tratamiento actual, le sugerimos que investigue el potencial de los perfiles genómicos. Esto proporciona un conocimiento profundo de su tipo de cáncer de mama. Mediante la búsqueda rigurosa de su ADN, se identifican los cambios en los genes que podrían hacerla candidata para diferentes tratamientos o ensayos clínicos. Ciertos cambios en los genes pueden hacerla candidata para un tratamiento específico. Otros hallazgos no son tan directos como éstos, y es la acumulación de varios factores lo que ayudará a decidir la mejor opción de tratamiento para usted. Entre ellos se encuentran Foundation Medicine, Guardant360, Claris y Tempus. Es vital tener en cuenta que debe discutir esto con su oncólogo. Juntos podréis decidir si puede mejorar tu tratamiento.
“Me diagnosticaron un cáncer de mama RE+ (8/8) (puntuación que indica el grado de ER+ del cáncer de mama – véase el blog del informe patológico) a la edad de 38 años, hace 4 años. Después de la quimioterapia y la radioterapia, empecé a tomar tamoxifeno y Zoladex® para suprimir mis ovarios. Aproximadamente un año y medio después del tratamiento activo, me extirparon los ovarios y me cambiaron a letrozol. A finales de 2020, pagué de forma privada las pruebas genéticas y las pruebas incluían mi respuesta a los medicamentos. Resulta que no proceso bien el tamoxifeno. Hay una cosa que sé con certeza, el tamoxifeno no es un medicamento complicado y si no es eficaz, no hace falta que lidie con sus efectos secundarios. Algunas personas dejan los medicamentos porque les resulta difícil. Yo no lo hice.”
– Karlee, del podcast Mommy Had a Little Cancer (@mommyhadalittlecancer on Instagram)
Esperamos que haya disfrutado de la lectura de nuestro blog y que, con estos conocimientos, entienda mejor la resistencia a la terapia hormonal y sea consciente de las posibles implicaciones de su plan de tratamiento. Puede ser increíblemente angustioso no tener confianza en su tratamiento contra el cáncer de mama y saber si está funcionando o no. Las exploraciones rutinarias os harán saber a usted y a sus médicos durante las revisiones, pero durante el periodo intermedio, es importante hacer un seguimiento de cualquier cambio en su cuerpo y compartirlo.
Referencias
- P.G. Alluri, C. Speers, A.M. Chinnaiyan. (2014) Estrogen receptor mutations and their role in breast cancer progression. Breast Cancer Res., 16 (6).
- Musgrove EA, Sutherland R. (2009). Biological determinants of endocrine resistance in breast cancer. Nat Rev Cancer 9:631–43.
- Quirke V. (2017) Tamoxifen from Failed Contraceptive Pill to Best-Selling Breast Cancer Medicine: A Case-Study in Pharmaceutical Innovation. Frontiers in Pharmacology. 8
- Harvey, J. M., Clark, G. M., Osborne, C. K. & Allred, D. C. (1999) Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. J. Clin. Oncol. 17, 1474–1481
- Najim, O., et al. (2019) The association between type of endocrine therapy and development of estrogen receptor-1 mutation(s) in patients with hormone-sensitive advanced breast cancer: A systematic review and meta-analysis of randomized and non-randomized trials. Biochimica et Biophysica Acta (BBA) – Reviews on Cancer. 1872(2):188315.
- C. Fribbens, B. O’Leary, L. Kilburn, S. Hrebien, I. Garcia-Murillas, M. Beaney, et al. (2016) Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast Cancer J. Clin. Oncol., 34(25):2961-2968
- J.M. Spoerke, S. Gendreau, K. Walter, J.H. Qiu, T.R. Wilson, H. Savage, et al. (2016) Heterogeneity and clinical significance of ESR1 mutations in ER-positive metastatic breast cancer patients receiving fulvestrant. Nat. Commun., 7
- Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). (2005) Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 365:1687–1717.
- NICE.org. (2012). Everolimus (Afinitor) in combination with exemestane for the treatment of advanced or metastatic HER2 negative, hormone receptor positive breast cancer after prior endocrine therapy. [online] Available at: https://www.nice.org.uk/guidance/ta295/documents/breast-cancer-her2-negative-oestrogen-receptor-positive-locally-advanced-or-metastatic-everolimus-with-an-aromatase-inhibitor-afinitor2
- Royal Marsden.nhs.uk. (2016)Blood test for new breast cancer subtype delays its progression. [online] Available at: https://www.royalmarsden.nhs.uk/news-and-events/news/blood-test-new-breast-cancer-subtype-delays-its-progression
- Breastcancer.org. (2020). CDK4/6 Inhibitors for Metastatic Breast Cancer: Ibrance, Kisqali, Verzenio. [online] Available at: https://www.breastcancer.org/treatment/targeted_therapies/cdk46-inhibitors
- Francesco Schettini, MD, Fabiola Giudici, MSPH, Mario Giuliano, MD, Massimo Cristofanilli, MD, Grazia Arpino, MD, Lucia Del Mastro, MD, Fabio Puglisi, MD, Sabino De Placido, MD, Ida Paris, MD, Pietro De Placido, MD, Sergio Venturini, PhD, Michelino De Laurentis, MD, PierFranco Conte, MD, Dejan Juric, MD, Antonio Llombart-Cussac, MD, Lajos Pusztai, MD, Aleix Prat, MD, Guy Jerusalem, MD, Angelo Di Leo, MD, Daniele Generali, MD. (2020) Overall Survival of CDK4/6-Inhibitor–Based Treatments in Clinically Relevant Subgroups of Metastatic Breast Cancer: Systematic Review and Meta-Analysis, JNCI: Journal of the National Cancer Institute. 112(11):1089–1097.
- pathways.nice.org.uk. (7AD). Advanced breast cancer – NICE Pathways. [online] Available at: https://pathways.nice.org.uk/pathways/advanced-breast-cancer [Accessed 07 January. 2021].
- Nice.org.uk. (2019) Abemaciclib with an aromatase inhibitor for previously untreated, hormone receptor-positive, HER2-negative, locally advanced or metastatic breast cancer. [online] Available at: https://www.nice.org.uk/guidance/ta563/chapter/3-Committee-discussion [Accessed 07 January. 2021].
- Baselga, J., Campone, M., Piccart, M., Burris, H.A., Rugo, H.S., Sahmoud, T., Noguchi, S., Gnant, M., Pritchard, K.I., Lebrun, F., Beck, J.T., Ito, Y., Yardley, D., Deleu, I., Perez, A., Bachelot, T., Vittori, L., Xu, Z., Mukhopadhyay, P., Lebwohl, D. and Hortobagyi, G.N. (2012). Everolimus in Postmenopausal Hormone-Receptor–Positive Advanced Breast Cancer. New England Journal of Medicine, 366(6), pp.520–529.
- Sledge, G.W., Toi, M., Neven, P., Sohn, J., Inoue, K., Pivot, X., Burdaeva, O., Okera, M., Masuda, N., Kaufman, P.A., Koh, H., Grischke, E.-M., Conte, P., Lu, Y., Barriga, S., Hurt, K., Frenzel, M., Johnston, S. and Llombart-Cussac, A. (2020). The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor–Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy—MONARCH 2. JAMA Oncology, 6(1), p.11
